Nghiên cứu nhằm xác định phương pháp sinh sản cá song chanh (Epinephelus malabaricus) tại Việt Nam.
Tóm tắt
Nghiên cứu nhằm xác định phương pháp sinh sản cá song chanh (Epinephelus malabaricus) tại Việt Nam. Các thí nghiệm được triển khai đã xác định được phương pháp nuôi vỗ thành thục đàn cá bố mẹ khi sử dụng các loại thức ăn giàu dinh dưỡng khác nhau; xác định được 2 phương pháp cho sinh sản tự nhiên và sử dụng kết hợp hormone (liều lượng cá cái: 500UI HCG + 25 µg LHRH a3; liều lượng cho cá đực = 1/2 cá cái) đều cho tỷ lệ cá tham gia sinh sản (100%), tỷ lệ thụ tinh (57,6 – 87,5%), tỷ lệ nở (65,3 – 87,1%). Nghiên cứu cũng đã theo dõi và phân biệt được các giai đoạn phát triển của phôi cá song chanh.
Từ khóa: Cá song chanh, Epinephelus malabaricus, ấu trùng, sinh sản, tỷ lệ thụ tinh.
1. Đặt vấn đề
Cá song chanh (cá mú chấm đen) có tên tiếng anh là black spotted grouper, malabar grouper; tên khoa học Epinephelus malabaricus Bloch & Schneider, 1801 là loài cá rạn san hô. Do đặc điểm sinh trưởng nhanh, dễ thích ứng với điều kiện môi trường nuôi, thịt ngon nên cá song chanh là đối tượng cá biển nuôi quan trọng ở một số nước như: Đài Loan, Trung Quốc, Thái Lan, Việt Nam,…
Cũng giống với các đối tượng cá song (Epinephelus sp) khác, nghiên cứu sản xuất nhân tạo giống cá song chanh nói chung đều có các công đoạn khó khăn về công nghệ cần giải quyết: chuyển đổi giới tính (từ cá cái thành cá đực), kích thích sinh sản, ấu trùng phát triển trải qua nhiều giai đoạn và đặc biệt rất nhạy cảm với điều kiện môi trường,… Tại Việt Nam, cá song chanh (E. malabaricus) là đối tượng được quan tâm và đưa vào danh mục bảo tồn nguồn gen Thủy sản từ năm 2008. Bài báo cáo này trình bày một số kết quả ban đầu trong nghiên cứu chuyển đổi giới tính, sinh sản và theo dõi sự phát triển phôi cá song chanh (Epinephelus malabaricus) thuộc nhiệm vụ “Bảo tồn, lưu giữ nguồn gen và giống Thủy sản khu vực miền Bắc” được triển khai tại Cát Bà – Hải Phòng.
2. Vật liệu và phương pháp nghiên cứu
Vật liệu và thời gian nghiên cứu
Vật liệu
* Cá song chanh (Epinephelus malabaricus); khối lượng 6,5 – 12,3 kg; độ tuổi: 5+.
* Thiết bị, vật tư chính khác: Kính hiển vi, trắc vi: Hund (Đức); Hormone (17a-MT, HCG, LHRH a3): Ningbo Shangsheng Pharmaceutical (Trung Quốc)
Thời gian nghiên cứu: từ tháng 01 – 12/2014.
Địa điểm triển khai: Trung tâm Quốc gia Giống Hải sản miền Bắc – Viện nghiên cứu nuôi trồng Thủy sản 1 (Cát Bà – Cát Hải – Hải Phòng)
Phương pháp nghiên cứu
Phương pháp nghiên cứu chuyển đổi giới tính
Phương pháp nuôi giữ, nuôi vỗ thành thục
+ Đàn cá song chanh được nuôi giữ, nuôi vỗ trong lồng (Việt Hải – Cát Bà).
+ Thức ăn được sử dụng là các loại cá, mực tươi, cá nhâm, cá nục, cá trích, mực, cua, ghẹ,… định kỳ (1 tháng/lần) bổ sung Vitamin và khoáng chất.
Phương pháp chuyển đổi giới tính: bố trí 2 lô thí nghiệm:
+ Lô thí nghiệm 1 (ký hiệu HM): Số lượng 32 cá thể cái, sử dụng hormone 17a – Methyl testosterone (17a – MT), liều lượng và thời gian theo Bảng 1.
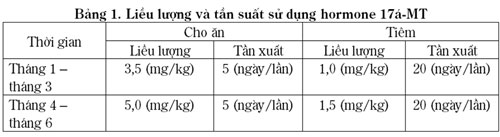
+ Lô đối chứng (ký hiệu ĐCHM): Số lượng 33 cá thể cái, không sử dụng hormone.
Phương pháp nghiên cứu kích thích sinh sản
Kiểm tra chọn cá cho sinh sản: – cá cái: thăm trứng bằng ống silicon có đường kính trong = 800 µm, lựa chọn cá cái có trứng tròn đều, rời nhau, đường kính > 550 µm;
– cá đực: lựa chọn cá có sẹ đặc, trắng, tan nhanh trong môi trường nước biển.
– Cho đẻ trong các bể có thể tích 90 m3, sâu 2,5m, kích thích sinh sản bằng chảy tràn nhẹ đảm bảo thay 200 – 300%.
+ Lô thí nghiệm cho sinh sản tự nhiên (ký hiệu SSTN): Cho nước chảy liên tục 24/24giờ với tốc độ 20m3/giờ, sự thay đổi nước mới kết hợp dòng chảy sẽ kích thích cá đẻ trứng và phóng tinh.
+ Lô thí nghiệm sử dụng hormone HCG + LHRH-a3 (ký hiệu SSNT) với liều lượng như sau: Cá cái: 500 UI HCG + 25µg LHRH-a3 /1kg; – Cá đực: 500 UI HCG + 15µg LHRH-a3/1kg.
2.2.3. Phương pháp nghiên cứu, đánh giá quá trình phát triển phôi
+ Tách trứng nổi (trứng thụ tinh), xử lý bằng iodin 10 ppm/15 phút. Mật độ trứng ấp khoảng 500 – 700 trứng/l. Sục khí nhẹ và có hệ thống nước chảy tràn đảm bảo thay tối thiểu 200% nước trong suốt thời gian ấp (khoảng 24h).
+ Định kỳ 15 phút/lần, theo dõi sự phát triển của phôi và chỉ tiêu khác
Phương pháp thu thập số liệu
– Tỷ lệ thành thục(%) = (số lượng cá đực, cái thành thục / tổng số cá nuôi vỗ) x 100%
– Tỷ lệ chuyển đổi giới tính (%) = (số cá đực / số cá theo dõi) x 100%
– Tỷ lệ thụ tinh (%) = (số trứng thụ tinh/ tổng số trứng thu được) x100%
– Tỷ lệ nở (%) = (số lượng cá bột/số lượng trứng thụ tinh) x 100%
Phương pháp phân tích và xử lý số liệu
+ Phân tích sự phát triển của phôi cá song chanh theo phương pháp của Blaxter J.H.S (1969); Branko Glamuzila và cộng sự (2000); Nguyễn Mộng Hùng (1993).
+ Số liệu được so sánh và kiểm định bằng giá trị x2 (mức ý nghĩa p<0,001); phân tích thống kê mô tả bằng phần mềm Microsoft office Excel 2007.
3. Kết quả và thảo luận
Kết quả chuyển đổi giới tính
Các loài cá thuộc họ Serranidae, đặc biệt là họ phụ Epinephelinae có đặc điểm chung là biến tính cái – đực. Giai đoạn đầu, hầu hết là con cái, rất ít cá thể tự chuyển đổi thành đực. Đến tuổi thứ 6 – 7, một số cá cái mới tự chuyển thành cá đực. Theo các tác giả Toledo (1993); Marte et al. (1999), đối với loài cá song chấm nâu (E. coioides), con cái thành thục khi trọng lượng 3 – 5kg, con đực từ 6 – 12 kg. Trong nghiên cứu sản xuất giống các loài cá song Epinephelus, việc chuyển đổi thành công cá đực là vấn đề quan trọng nhất trong sinh sản.
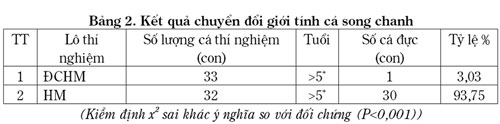
Kết quả chuyển đổi giới tính cá song chanh (Bảng 2), tại lô thí nghiệm không sử dụng hormone (ĐCHM) chỉ có 1 cá thể cái tự chuyển giới tính thành cá đực, chiếm tỷ lệ 3,03%. Trong khi đó, 32 cá thể được bổ sung 17a –Methyltestosterone đã có 30 cá thể chuyển thành cá đực (93,75%). Kiểm định x2, (p<0,001) đã cho thấy mối tương quan chặt chẽ giữa hormon với sự chuyển đổi giới tính cá song chanh.
Kết quả nghiên cứu cũng tương tự các kết quả chuyển đổi giới tính ở cá song chấm nâu (E. coioides) của tác giả Shin-Lih Yeh và cộng sự (2003): Nhóm tác giả đã sử dụng 17a -MT trộn vào thức ăn với liều lượng cao (1.000µg; 10.000 µg; 20.000 µg/kg trọng lượng cơ thể) kết quả sau 90 ngày 86 – 90% cá đã hoàn toàn chuyển thành con đực. Josefa và cộng sự (1993) đã thí nghiệm trên cá song E. suilus, tác giả đã tiêm 17 – MT với liều lượng 0 – 5 mg/kg khối lượng cơ thể, tần suất 15 ngày/lần. Thí nghiệm với liều lượng hormone 5,0 mg/kg, sau từ 6 lần tiêm (với cá có khối lượng 1,2 – 1,6 kg) và 12 lần tiêm (với cá có khối lượng 0,8 kg) (trong 3 – 6 tháng), kết quả là 100% số cá thí nghiệm đã chuyển hoàn toàn thành cá đực.
Kết quả nuôi thành thục
Kết thúc quá trình nuôi vỗ trong thí nghiệm, tỷ lệ cá cái có tuyến sinh dục ở giai đoạn IV đạt tỷ lệ 65,6%; cá đực (khả năng tham gia sinh sản) đạt 86,7%; (13,3% số cá đực còn lại tinh loãng, tỷ lệ tinh trùng bất hoạt cao > 50% khi quan sát trên kính hiển vi). Kết quả nuôi thành thục là cao hơn kết quả nghiên cứu của Ruangpanit (1993), tác giả đã sử dụng cá mòi tươi, mực với khẩu phần ăn hàng ngày 1-2%/kg khối lượng cá, bổ sung vitamin C, Premix, vitamin E để thúc đẩy sự thành thục của cá song chanh bố mẹ, tỷ lệ thành thục chỉ đạt 56-72,1%.
Kết quả thử nghiệm sinh sản
Nghiên cứu thử nghiệm phương pháp kích thích sinh sản với cá 20 cặp cá bố mẹ (khối lượng 6,5 – 9,7 kg) theo 2 phương pháp: cho đẻ tự nhiên (SSTN) và sinh sản nhân tạo (SSNT). Phân tích kết quả tại Bảng 3, cả 2 phương pháp đều cho tỷ lệ 100% số cá tham gia sinh sản. So sánh tổng số trứng sinh sản, lượng trứng thu được từ lô SSNT cao hơn lô SSTN. Sức sinh sản thực tế của cá song chanh khi được tiêm hormone là cao hơn (2,7/2,1). Tuy nhiên, khi đánh giá các chỉ tiêu tỷ lệ thụ tinh, tỷ lệ nở, lô thí nghiệm SSTN đạt lần lượt (trong các lần đẻ) là 79,5 – 87,5% (trung bình 81,3 + 4,5%) cao hơn so với SSNT là 57,6 – 65,8% (trung bình 59,8+7,5%). Tỷ lệ dị hình của ấu trùng cá song chanh nở từ phương pháp SSTN trung bình đạt 3,2+0,5% cũng thấp hơn so với SSNT (4,1+0,7%).
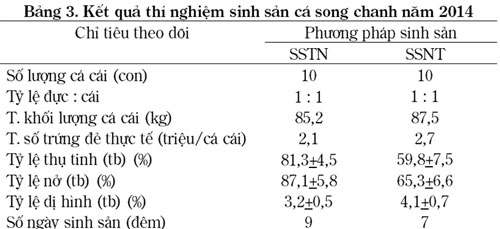
Nghiên cứu cũng đã xác định mùa vụ sinh sản chính của cá song chanh tại miền Bắc Việt Nam trong khoảng 2 tháng (từ tháng 6 – 7); có một số khác biệt với Ruangpanit (1993), tác giả đã cho sinh sản tự nhiên cá song chanh với 6 cá cái (3,5 – 5,0 kg) và 4 cá đực (7 – 12 kg) thành thục trong bể 50 m3, kết quả đã cho đẻ thành công từ 5 – 17 lần/tháng trong 10 tháng năm 1991 (trừ tháng 11,12). Sự sai khác này có thể do điều kiện thời tiết tại Thái Lan là ổn định hơn khu vực nghiên cứu của nhiệm vụ tại Cát Bà.
Quá trình phát triển phôi
Quan sát quá trình phát triển phôi cá song chấm nâu cơ bản cũng trải qua các giai đoạn phát triển chính như phôi của các đối tượng cá song khác như: cá song mỡ (E. tauvina) (Hussain N.A. & Higuchi M., 1980), cá song (E. microdon) (Tawada S.,1989b); cá song (E. costae) (Branko Glamuzila et al., 2000)…. Trứng thụ tinh cá song chanh phát triển bình thường cũng trải qua các giai đoạn: thụ tinh, phân cắt tế bào, phôi dâu, phôi nang, phôi vị, phôi thần kinh và nở thành cá bột (Bảng 4, Hình 1).
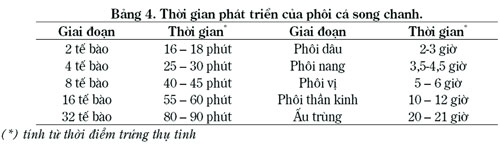
Thời gian phát triển phôi, tỷ lệ nở, tỷ lệ dị hình của ấu trùng phụ thuộc vào nhiệt độ và độ mặn. Qua các thí nghiệm, nhóm nghiên cứu đã xác định được tại điều kiện tối ưu cho ấp nở trứng thụ tinh là: độ mặn: 28 – 30‰, nhiệt độ: 27 – 290C, mật độ: 500 – 700 trứng/lít, nước chảy tràn với tỷ lệ thay đạt 300%/chu trình ấp nở, thời gian nở thành ấu trùng trung bình 22 ± 0,5 giờ.

Kết quả nghiên cứu của chúng tôi cũng tương tự với một số tác giả khác. Theo Duray và đồng tác giả (1997), phôi cá song chấm nâu (E. coioides) nở sau thụ tinh 18 – 20 giờ (nhiệt độ 28 – 300C). Phôi cá song chanh (E. malabaricus) nở thành ấu trùng trong thời gian 17 – 19 giờ tại nhiệt độ 26 – 290C (Ruangpanit, 1993). Với cá song chuột (Cromileptes altivelis), quá trình phát triển phôi trong khoảng thời gian sau 20 giờ tại nhiệt độ 28 – 290C (Sugama et al., 2001).
4. Kết luận
1) Sử dụng hormone 17 -MT (tiêm kết hợp cho ăn) trong chủ động chuyển đổi giới tính cá song chanh (Epinephelus malabaricus); tỷ lệ cá chuyển thành cá đực đạt 93,75%.
2) Phương pháp SSTN đạt tỷ lệ thụ tinh (79,5-87,5%), tỷ lệ nở trung bình đạt 87,1%; cao hơn phương pháp SSNT: (57,6-65,8%; 65,3%).
3) Phôi cá song chanh phát triển qua các giai đoạn giống sự phát triển phôi của một số loài cá song (Epinephelus sp) khác.
Tài liệu tham khảo
1. Blaxter J.H.S (1969). Development: eggs and larvae. In: W.S. Hoar and D.J. Randal (Editors). Fish physiology. Vol. 11. Academic Press, San Diego C.A. 1-58.
2. Branko Glamuzila, Niska Glavic, Pero Tutman,Valter Kozul and Bosvko Skaramuca (2000). Egg and early larval development of laboratory reared goldblotch grouper, Epinephelus costae (Steindachner, 1878). Sci. Mar., 64(3); pp. 341 – 345.
3. Duray M.N., Kohno H., (1990). The relationship between mouth width and larval length to prey size in three marine fish species. Philipp. J. Sci. 119, 237-245.
4. Hussain N.A. & Higuchi M. (1980). Larval rearing and development of the brown-sportted grouper, Epinephelus tauvina (Forskal). Aquaculture 19, 339-350.
5. Josefa D. Tan-Fermin, Luis Maria B. Garcia and Antonio R. Castillo, Jr, (1994). Induction of sex inversion in Juvenile Grouper, Epinephelus suillus, (Valenciennes) by Injections of 17á-Methyltestosterone. Japan.J.chthyol 40 (4), 413-420.
6. Marte C.L., (2003). Laviculture of marine species in Southeast Asia: current research and industry prospects. Aquaculture 227 (2003): 293-304.
7. Nguyễn Mộng Hùng (1993). Bài giảng sinh học và phát triển. NXB Khoa học và kỹ thuật.
8. Ruangpanit N., Boonliptanon P. & Kongkumnerd J. (1993). Progess in the propagation and larval rearing of the grouper Epinephelus malabaricus. In: Grouper Culture, The Proceedings of Grouper Culture, pp. 32-44.
9. Shinn – Lin Yeh, Quen – Chai Dai, Yeong – Torng Chu, Ching – Ming Kuo, Yun – Yuan Ting, Ching – Fong Chang, (2003). Induced sex change, spawning and larviculture of potato grouper, Epinephelus tukula. Aquaculture 228, 371 – 381.
10. Sugama K., Tridjoko, Bejo Slamet, Suko Ismi, Eri Setiadi and Shogo Kawahara (2001). Manual for the seed production technique of Humpback grouper Cromileptes altivelis. Gondol Research Institute for Mariculture (Indonesia).
11. Tawada S. (1989a). Development of eggs, larvae and juvenile of the grouper Epinephelus microdon (Bleeker) reared ing the hatchery. Suisanzoshoku H1, 99-103 (in Japanese)
12. Tawada S. (1989b). Spawning of brood stock of the grouper Epinephelus microdon (Bleeker). Suisanzoshoku H1, 105-108 (in Japanese)
13. Toledo J.D., (1993). Successive spawning of grouper, E suillus in a tank and a floating net cage. Aquaculture,115: p 361-367.