(TSVN) – Peptide kháng khuẩn (Antimicrobial peptides – AMP) hoạt động trực tiếp như kháng sinh tự nhiên tiêu diệt mầm bệnh bằng cách sử dụng phương thức hoạt động cụ thể khác với kháng sinh thông thường. Nghiên cứu dưới đây đã đánh giá tác dụng kháng khuẩn của SpPR-AMP1 với mầm bệnh V. campbellii VH-639 trên tôm thẻ chân trắng.
AMP đại diện cho một nhóm các phân tử peptide được tiến hóa với các hoạt động kháng khuẩn và/hoặc điều hòa miễn dịch có trong tất cả các sinh vật sống và đóng vai trò là phân tử quan trọng trong cơ chế bảo vệ bẩm sinh của vật chủ. Ngoài ra, một số AMP cũng tham gia điều chỉnh khả năng miễn dịch bẩm sinh của vật chủ đa dạng. Ở động vật giáp xác, một số AMP đã được báo cáo và mô tả, bao gồm cả lớp vỏ, yếu tố kháng lipopolysaccharide (ALF), penaeidin, stylicins, AMP giàu proline (PR-AMP), AMP giàu glycine (GR-AMP), arasin, hyastatin, astcidin, panusin, paralithocin, armadillidin và theromacin. Tuy nhiên, AMP với vai trò là tác nhân trị liệu thay thế tiềm năng để phát triển khả năng kháng lại các vi sinh vật gây bệnh trong ứng dụng nuôi tôm vẫn còn hạn chế.

Bảng 1. Đặc điểm và hoạt tính kháng khuẩn của peptide SpPR- AMP1 tổng hợp chống lại V. campbellii VH-639.
Kết quả cho thấy SpPR-AMP1 thể hiện hoạt tính kháng khuẩn mạnh đối với V. campbellii VH-639 với giá trị MIC là 0,195 – 0,39 μM và giá trị MBC là 3,125 μM (Bảng 1). Sau đó, ảnh hưởng của SpPR-AMP1 đến những thay đổi hình thái của tế bào V. campbellii VH-639 được đánh giá bằng phân tích SEM. Như được hiển thị trong Hình 1, một hình thái bất thường đã được phát hiện trong các tế bào V. campbellii VH-639 được xử lý bằng SpPR-AMP1, so với màng ngoài của các tế bào vi khuẩn ở nghiệm thức đối chứng. Các tế bào vi khuẩn được xử lý với liều MIC của SpPR-AMP1 trong 1 giờ có biểu hiện bất thường bao gồm sự co rút và nếp gấp của màng tế bào (Hình 1B và C). Đồng thời, các bong bóng nhỏ nhô ra và các vết lõm bổ sung cũng được phát hiện trên bề mặt tế bào vi khuẩn. Điều thú vị là, tổn thương rõ ràng hơn và hình thành lỗ chân lông ở màng ngoài đã được quan sát thấy sau khi tế bào V. campbellii VH-639 được xử lý với liều SpPR- AMP1 (10 × MIC) cao hơn và màng vi khuẩn thậm chí còn bị vỡ nhiều hơn và các tế bào bị ly giải và mảnh vụn tế bào cũng được phát hiện (Hình 1 D và E).
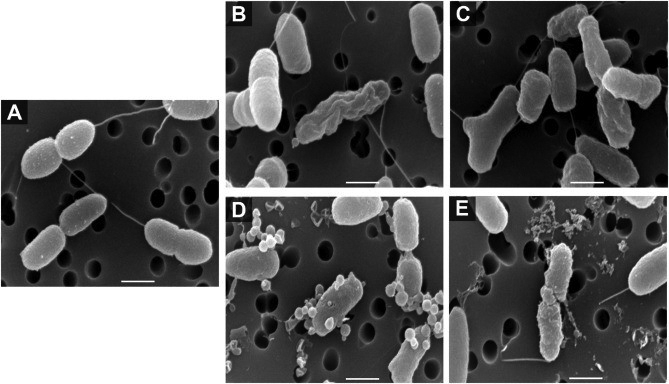
Hình 1. Quét ảnh hiển vi điện tử của vi khuẩn Vibrio campbellii VH-639 sau khi xử lý bằng peptide SpPR-AMP1. (A) Kiểm soát không có peptide; (B và C) SpPR-AMP1 ở mức 1 × MIC; (D và E) SpPR-AMP1 ở mức 10 × MIC
Tác dụng của SpPR-AMP1 đối với việc điều chỉnh biểu hiện gen miễn dịch của tôm
Tiêm SpPR-AMP1 với liều lượng 5 μg/g tôm không có tác dụng độc hại đối với tôm so nhóm đối chứng (dữ liệu không được hiển thị). Các mẫu tế bào máu sau đó được thu thập vào khoảng thời gian 0, 6, 24 và 48 giờ sau khi tiêm peptide và phân tích RT-PCR về mức độ biểu hiện của gen miễn dịch ở tôm được thực hiện. SpPR-AMP1 có thể kích hoạt sự biểu hiện của các gen peptide kháng khuẩn bao gồm ALF (LvALF; DQ208703), penaeidin (LvPEN3; DQ206403) và rustin (LvCrus; AY486426) và phân tử liên quan đến kháng khuẩn lysozyme (LvLyz ; AY170126) trong tế bào máu tôm. Biểu hiện mRNA của LvALF được điều chỉnh tăng đáng kể ở mức 24 hpi-48 giờ. Biểu hiện mRNA của LvPEN3 được điều chỉnh tăng đáng kể ở 48 giờ. Biểu hiện mRNA của LvCrus được điều chỉnh tăng đáng kể ở thời điểm 6 và 48 giờ. Đối với LvLyz, mức biểu hiện mRNA được điều chỉnh giảm đáng kể xuống 0,14 lần sau 6 giờ và sau đó được điều chỉnh tăng để đạt mức tối đa 1,88 lần sau 24 giờ trước khi giảm xuống mức biểu hiện bình thường ở 48 giờ.
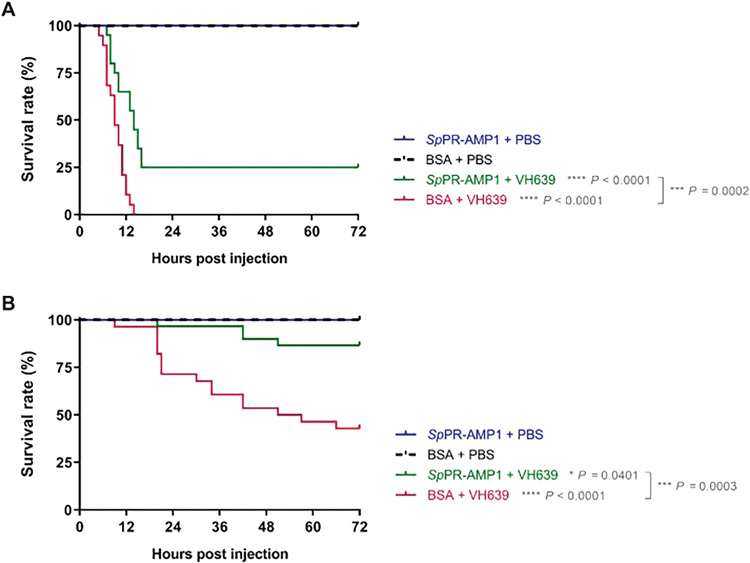
Hình 2. Tác dụng miễn dịch của SpPR-AMP1 trong việc tăng cường khả năng chống nhiễm V. campbellii VH-639 ở tôm
Kết quả cho thấy, tỷ lệ sống của tôm được xử lý trước bằng SpPR-AMP1 trước cảm nhiễm V. campbellii VH-639 (SpPR-AMP1 + VH639) cao hơn đáng kể so nhóm đối chứng được xử lý trước bằng BSA trước cảm nhiễm V. campbellii VH-639 (BSA + VH639) có tỷ lệ sống sót là 0% trong vòng 16 hpi (Hình 2A). Không phát hiện thấy tôm chết tích lũy ở tôm đối chứng không bị nhiễm bệnh được điều trị bằng SpPR-AMP1 hoặc BSA mà không gặp phải cảm nhiễm vi khuẩn. Trong thí nghiệm song song, V. campbellii VH-639 (1 × 105 cfu) được ủ với peptide SpPR-AMP1 trước khi áp dụng cho tôm. Kết quả cho thấy tôm nhận được SpPR-AMP1 và V. campbellii VH-639 (SpPR-AMP1 + VH639) được xử lý đồng thời có tỷ lệ sống cao hơn đáng kể khoảng 87% so nhóm đối chứng nhận vi khuẩn đối chứng (BSA + VH639) có tỷ lệ sống là 43% (Hình 2B). Đối với các đối chứng bổ sung không bị lây nhiễm, không phát hiện trường hợp tử vong.
Tôm thí nghiệm được xử lý bằng SpPR-AMP1 trước cảm nhiễm V. campbellii VH-639. Nhóm đối chứng là tôm nhận được BSA sau đó cảm nhiễm. Huyết tán từ mỗi nhóm được thu thập ở mức 6 hpi và số lượng khuẩn lạc sau đó được thực hiện. Kết quả cho thấy rõ ràng rằng số lượng vi khuẩn trong huyết tương của tôm được xử lý bằng SpPR- AMP1 (5,7 × 102 cfu/mL) thấp hơn nhiều so nhóm đối chứng (7,5 × 103 cfu/mL) trong khoảng 13 lần (P < 0,05).
Kết quả từ các đoạn mồi PirA và PirB ở 35 chu kỳ PCR trong phương pháp xử lý SpPR-AMP1 + VH639 cho thấy không có dải nhìn thấy được, trái ngược với phương pháp xử lý BSA + VH639, chỉ ra rằng sự biểu hiện của gen PirA và PirB đã bị ức chế trong sự hiện diện của SpPR-AMP1. PirA và PirB được mã hóa bởi plasmid độc lực có trong V. campbellii VH-639. Trong nghiên cứu này, các tác giả đã chứng minh rằng việc xử lý in vivo bằng SpPR-AMP1 không chỉ làm giảm số lượng vi khuẩn trong huyết tương của tôm mà còn ngăn chặn mức độ biểu hiện của cả bản phiên mã gen độc tố PirA và PirB.
>> Những phát hiện này cho thấy tiềm năng của SpPR-AMP1 như một tác nhân trị liệu tiềm năng trong các ứng dụng nuôi tôm không chỉ điều chỉnh phản ứng miễn dịch của tôm mà còn có khả năng làm tăng sức đề kháng của tôm đối với V. campbellii VH-639, có thể bằng cách tiêu diệt trực tiếp vi khuẩn hoặc gián tiếp điều chỉnh mức độ biểu hiện của bản sao gen miễn dịch ở tôm.
Xuân Chinh
(Lược dịch)